- 한경일 서울내과 원장
대한임상순환기학회 부회장
 |
1. 심장대사증후군 개념의 시작과 흐름
대사증후군의 개념은 1988년 Reaven 교수가 처음으로 형식화한(Syndrome X) 이후, 심장혈관 위험을 촉진하는 기본 공통 인자로서 인슐린 저항성이 확인됐다. 즉, 체내에 인슐린이 분비되더라도 주요 장기의 인슐린저항성으로 인해 고혈당은 개선되지 않고, 인슐린 농도가 높아지는 것을 특징으로 한다. 10년 후 세계보건기구(WHO)는 이런 고위험의 개인을 식별하고 치료하기 위해 포괄적인 정의를 제공하려고 노력했고, 2003년 대사증후군(Metabolic syndrome, MetS)으로 지칭했다. 2014년 미국심장학회(ACC)에서는 심혈관질환을 일으키는 인자들이 한 개인에게서 동시에 존재하는 경우가 많아 심장대사증후군(Cardiometabolic syndrome, CMS)으로 명명했다. 국내에서는 이 명칭이 2015년 심장대사증후군 연구회(심대연)에서 처음 사용됐다. 최근 심장대사증후군학회에서 분석한 ‘Metabolic Syndrome Fact Sheet in Korea 2021’에 따르면, 우리나라의 성인 대사증후군 유병률은 22.9%(남자 27.9%, 여자 17.9%) 30세 이상은 약 1/3, 65세 이상은 약 1/2정도에 이르고 있다(그림 1).
 |
2. 심장대사관련 만성질환 최근 모델과 구체적 개념
미국심장학회저널(JACC)에서는 2020년 최신 지견으로 조기치료와 지속가능한 예방적 관리를 위해 심장대사에 근거한 만성질환 모델(Cardiometabolic-based chronic disease, CMBCD)을 제시했다. 이 모델에서는 1차 유발요소로 유전(genetics), 환경(environment), 행동(behavior) 세 가지를 꼽았고, 대사적 유발 요소로 지방성 만성질환(Adipocity-Based Chronic Disease, ABCD)과 혈당장애성 만성질환(Dysglycemia-Based Chronic Disease, DBCD) 두 가지를 제시했다. ABCD는 지방조직의 양, 분포, 기능 장애를 포함하는 복합 개념이며 단순히 비만(obesity)이라는 용어보다 과학적으로 정확한 표현이다.
혈당장애(dysglycemia)는 당뇨병뿐 아니라 당뇨병 전단계, 과인슐린 정상혈당도 포함하는 개념이다. DBCD는 ‘당뇨병’이라는 용어보다 더 활용 가능한 진단적인 표현으로 간주된다. ‘DBCD’라는 표현은 미국임상내분비학회(AACE)가 채택했다. 지방의 분포 및 이소성은 인슐린 저항성과 관련이 깊다. 둔부허벅지 지방(gluteofemoral adipose tissue) 증가는 유리지방산(FFA)을 가두어 심장대사질환으로부터 보호역할을 하는 반면, 심낭이나 간, 장, 췌장의 지방 침착은 반대 역할을 한다. 특히 심낭 주위나(epicardium/pericardium) 복부 내장 지방은 죽상동맥경화 부담을 반영하며 혈관 염증이나 동맥 경화도와 연관된다. 이런 유발요소들은 심혈관질환에 다양한 영향(관상동맥질환, 심부전, 심방세동)을 주는 것으로 알려진다(표).
 |
3. 최근 이슈 관련 심장대사질환
1) COVID-19 팬데믹 (COVID-19 Pandemic)
코로나바이러스 감염증-19(COVID-19)에 감염이 되면 직·간접적으로 내분비 및 대사관련 장기(뇌, 간, 췌장, 근육, 지방조직)에 손상을 주게 된다. 따라서 새로 고혈당이 발생하기도 하며 인슐린 저항성이 생기기도 한다. 추가적으로 활동저하, 식사습관의 변화, 동반된 체중 증가도 기여를 한다. 코로나로 사망하는 환자의 최대 50%까지 대사적질환과 혈관질환을 가지고 있었다.
국내에서 COVID-19로 확진된 4069명을 대상으로 대사증후군 위험인자와 중증 합병증의 연관성을 분석한 결과, 비만하더라도 대사증후군 위험인자가 없으면 중증 합병증이 발생할 위험이 유의하게 증가하지 않았다. 또 비만 여부와 상관없이 대사증후군 위험인자가 하나씩 증가할 때마다 COVID-19 중증 합병증 발생 위험이 13%씩 증가했다. 비만 자체보다 대사증후군 위험인자가 COVID-19 중증 합병증 발생에 밀접한 관계가 있다는 결과를 보였다. 주목할 점은 COVID-19과 대사 및 내분비 시스템이 다양한 직접적인 상호 연관성을 갖고 있다는 점이다(그림 2).
 |
2) 장내미생물총(Microbiome)과 대사질환
장내미생물총(Microbiome)은 장내 미생물 군집을 의미하는 마이크로바이오타(microbiota)와 유전체를 뜻하는 게놈(genome)의 합성어로 우리 몸에 사는 미생물의 유전정보 전체를 의미한다. 최근 건강하지 않은 장내미생물이 다양한 질병을 일으킨다는 연구결과가 많이 나오고 있고, 대사질환 역시 장내미생물과 밀접한 연관이 있다는 연구가 활발히 이뤄지고 있다. 현대인의 생활 방식이 장내미생물 군집을 바꿈으로써 여러 질병의 위험성을 높인다고 여겨지고 있는데, 실제 연구로 비만 쥐의 장내미생물을 마른 쥐에게 이식하자 마른 쥐에게서 지방이 과도하게 축적됐다. 대사증후군, 영양실조, 염증성 장질환, 심지어 암에 이르기까지 많은 질병들이 장내미생물과 연관이 있다는 것이 알려져 있다. 이는 개인의 유전적 요소와 출생 환경 및 식생활 요인이 함께 작용하여 결정된다.
최근 허혈성 심부전과 장내 미생물총의 불균형 사이에 상관관계가 밝혀지면서, 장내 미생물총의 조성 변화와 심장대사질환 사이에 연관성이 있음이 다시 한 번 강조됐다. 장내 미생물총으로부터 생산되는 TMAO(trimethylamine-N-oxide)는 동맥경화증의 생체 지표 중 하나로 여겨지고 있는데, 혈장내 TMAO 농도와 뇌졸중, 심근경색증 등의 질병 사이에 상관관계를 나타내는 연구결과 서로 상충되는 보고가 있었다.
그러나 최근 연구를 통해 TMAO가 숙주의 유전자 배경과 장내 미생물총의 조성에 따라 심장질환에 미치는 영향이 달라진다는 것이 확인됐다. TMAO가 심장질환의 위험성을 증가시키는 경우, 혈소판 응집, 동맥경화반 등과 같은 현상이 동반되므로 TMAO는 직접적으로 심혈관질환을 일으키기보다는 이미 이 질환을 앓고 있는 환자들의 상태를 악화시키는 역할로 작용할 것으로 생각되고 있다.
장내미생물총(Microbiome)은 대사산물 이외에 그들을 구성하는 성분들을 통해서도 숙주의 인슐린 감수성 및 내분비계에 영향을 미친다. 그람 음성균의 외막의 주요 성분인 LPS(lipopolysaccharide)는 박테리아가 사멸될 때 방출되어 숙주 면역체계를 자극시킨다. 이 물질은 동물성 지방이 과량으로 함유된 식품을 습관적으로 섭취하거나 패혈증(sepsis)에 의한 내독소(endotoxin)에 의해서도 체내에 수치가 증가하며, 그 결과 국소 및 전신 염증과 인슐린 저항성, 장벽 손상이 일어난다. 이러한 현상들이 상호작용하여 대사증후군으로 이어진다.
죽상동맥경화증에 직접적으로 영향을 미치는 미생물 종은 아직까지 보고된 바 없으나, 건강한 사람들과 심장대사질환 환자의 장내 미생물총의 조성에 차이가 있음이 확인됨에 따라 장내 미생물총의 불균형이 심장대사질환에 영향을 줄 것으로 생각되고 있다.
4. 통합된 심장대사의학의 정립 필요성 및 미래 통합 치료 방향
1) 통합된 심장대사의학의 정립 필요성 증가: 새로운 치료제의 등장
최근 근거에 기반을 둔 새로운 ‘심장대사 약물’이 개발됐고 이는 2형당뇨병뿐만 아니라 심혈관질환 치료에 쓰일 수 있음이 증명됐다. 임상에서는 특히 2가지 약물이 주목받고 있는데 SGLT-2억제제(SGLT-2 inhibitor)와 GLP-1수용체작용제(Glucagon-like peptide-1 receptor agonist, GLP-1RA)다.
SGLT-2억제제는 심장대사를 표적으로 하는 새로운 기전을 통해 심부전 환자의 잔류 위험을 낮추는 중요한 약제로, 당뇨병과 심혈관질환 두 영역을 동시에 충족시켜 줄 수 있는 적절한 치료 옵션으로 등장했다. 특히 심부전은 한 번 발생하면 입원을 반복하면서 사망 위험이 높아지는데, SGLT-2억제제는 심부전으로 인한 입원 감소 효과를 확인했을 뿐만 아니라 당뇨병을 동반하지 않은 심부전 환자에서도 예후를 개선시켰다.
비당뇨 환자를 포함한 만성 콩팥병 환자에 SGLT-2억제제를 투여해 신기능 감소, 말기신부전 발생, 및 신장 및 심혈관질환 관련 사망률을 약 40% 감소시킨 연구결과(DAPA-CKD)도 발표됐다.
새롭게 개정된 대한당뇨병학회의 진료지침에서는 심부전, 죽상경화 심혈관질환, 만성신장질환을 동반한 환자에서 관련 이익이 입증된 SGLT-2억제제 치료를 우선적으로 고려하도록 권고하면서 2형당뇨병 치료전략이 SGLT-2억제제 중심으로 심장과 신장까지 포괄적으로 관리하도록 재편되고 있다
GLP-1은 음식 섭취시 장의 L-cell에서부터 생성되는 인크레틴 호르몬으로, 포도당 농도에 의존적으로 인슐린 분비를 촉진하고 글루카곤 분비를 감소시켜 혈당 강화 효과를 나타내며 위에서 음식물의 통과를 지연시키고 뇌에 작용하여 식욕을 억제해 혈당조절 뿐 아니라 체중 감소에도 도움을 준다. 또한, 췌장 베타세포의 기능 호전과 인슐린 감수성에도 좋은 영향을 준다.
GLP-1RA는 체중 감소, 혈당 조절, 혈압 감소, 지질 개선 등 심혈관 질환의 위험인자들을 개선시킨다. 또한 심장 및 내피세포에 직접적인 효과를 나타내는데, 산화질소 증가, endothelin-1의 감소, 활성산소 감소, 염증 사이토카인 감소 등의 기전으로 죽상경화증의 진행을 예방하는 효과를 갖는 것으로 알려지고 있다.
미국당뇨병학회(ADA)는 2022년 당뇨병환자 진료 지침 개정을 통해 “2형당뇨병환자에서 인슐린보다 글루카곤 유사 펩타이드(GLP-1RA)가 선호된다”고 언급, GLP-1RA 사용 확대를 예고했다. 당뇨병 환자 다수가 심혈관질환을 동반한다는 점에서 ADA는 다양한 항목에서 동맥경화성 심혈관 보호효과가 입증된 GLP-1RA를 전진 배치했다. ADA의 2022년 당뇨병환자 진료지침 개정을 요약하면 SGLT-2억제제에 이은 GLP-1RA의 두드러진 선택이다.
2) 통합된 심장대사의학의 태동
이런 약물 개발은 더 나아가 전통적인 세부 전문가 사이의 경계를 허물게 되고 지금까지 단편화 된 의료의 모델을 다시 돌아보게 하는 계기가 되었다. 다양한 각 분야의 전문가가 쪼개듯이 나누어 진료를 하는 것은 불충분한 치료, 고비용, 바람직하지 않은 결과를 낳을 수 있다. 이런 이슈와 문제점을 해결하고자 미국에서는 심장대사의학 통합 전문의와 클리닉의 등장이 제안되고 있다(그림 3).
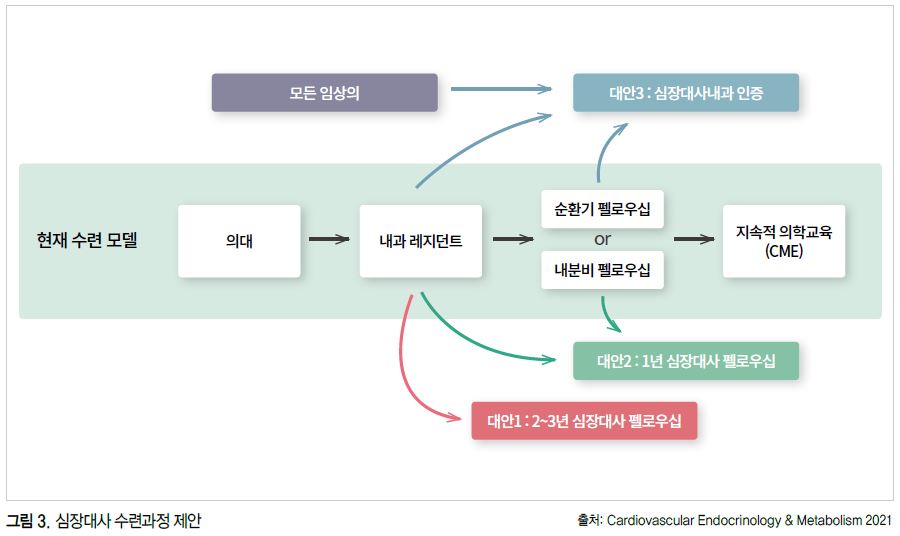 |
3) 미래 통합 치료 방향
심혈관질환의 죽상경화가 주로 염증 과정에 의해 발생해 진행되고 위험인자 관리 조절에 따라 진행 속도와 방향이 결정되므로, 심장대사증후군 구성 위험인자들에 대한 철저한 관리가 심혈관질환 예방과 예후 개선에 중요하다. 다른 질환과 달리 심장대사증후군은 예방과 조기 치료가 가능한 질환이다. 심장대사증후군을 효과적으로 관리하기 위해서 이에 대한 적극적인 통합 진료와 체계적인 지침이 필요한 시점이다.
대한임상순환기학회에서도 이에 대한 중요성을 인지하고 ‘심장대사의학연구회’를 만들어 새로운 약물에 대한 정확한 이해와 적용 방법을 익히고 최근 지식과 다양한 사례를 공유하고 있다. 학술대회나 정기적인 의학교육(continuing medical education, CME)을 통한 방법으로 회원과 지속적으로 소통하려고 한다.
THE MOST webmaster@mostonline.co.kr
